2024年11月13日,44118太阳成城集团胡颖教授课题组在结直肠癌抵抗铁死亡的分子机制的研究方面取得重要进展。相关研究成果以AKAP1/PKA-mediated GRP75 phosphorylation at mitochondria-associated endoplasmic reticulum membranes protects cancer cells against ferroptosis为题发表在国际期刊Cell Death & Differentiation。该研究从信号转导局域性的调控角度揭示了结直肠癌耐受铁死亡的新机制,并基于此为结直肠癌的有效治疗提供了新思路。
铁死亡是一种新型细胞死亡方式,该团队前期鉴定出了铁死亡时间依赖性调控机制,并基于此提出老药新用靶向铁死亡治疗结直肠癌的新方法。在此基础上,该团队进一步揭示了空间局域性信号对铁死亡的精细调控作用。线粒体相关内质网膜结构(MAMs)是有蛋白复合物链接而成,介导线粒体与内质网细胞器互作的纳米级结构域,参与氧化应激、钙稳态以及脂质转运等多种生物学过程。GRP75(Mortalin/HSPA9)是HSP70家族的成员之一,在多种恶性肿瘤组织中表达上调,且与结肠癌的不良预后和治疗耐受相关。蛋白特异性的亚细胞定位决定其功能,研究发现GRP75主要定位于线粒体基质,通过调控线粒体蛋白的输入、折叠和降解来维持线粒体稳态。值得注意的是,虽然部分GRP75也可特异性地定位于MAMs,但是调控GRP75在不同细胞亚结构分布的机制以及对氧化应激特别是脂质过氧化的应答和调控机制的却尚未明确。
团队成员综合运用生物信息学手段发现GRP75在结直肠癌中与活性氧代谢以及脂质代谢相关,这些途径是影响铁死亡敏感性的核心分子机制。实验研究发现在铁死亡的过程中GRP75发生了从线粒体到MAM及细胞质的分布改变,进而发挥抵抗铁死亡的作用,抑制其定位改变可有效曾敏肿瘤细胞对铁死亡的敏感性。
在铁死亡条件下,脂质过氧化主要积聚在内质网,以cAMP依赖性的方式激活蛋白激酶A (PKA)。早期的研究发现,线粒体外膜蛋白激酶A锚定蛋白1 (AKAP1)可将PKA锚定在线粒体外膜上,在局域内发挥其激酶功能。在铁死亡情况下AKAP1锚定的PKA特异性的在MAMs局域磷酸化GRP75的S148位点。这导致GRP75被隔离在线粒体外,并在局部的细胞微域内通过其保守的高亲和力RGD-结合基序ETGE与Nrf2竞争性结合Keap1(细胞内Nrf2的主要抑制因子)。Nrf2随后被稳定和激活,进入细胞核导致一系列抗铁死亡基因的转录。多种体内外模型的研究发现,AKAP1/PKA/GRP75信号轴对结直肠癌的铁死亡敏感性具有重要调控作用。
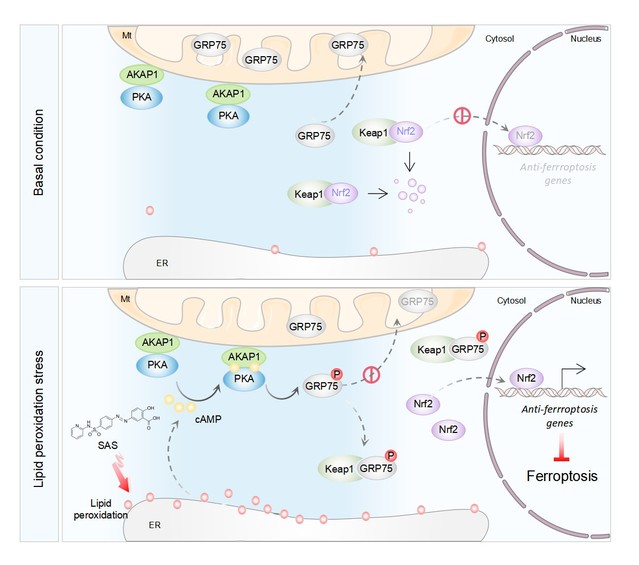
总的来说,本研究发现PKA在MAMs局域磷酸化GRP75,保护肿瘤细胞耐受铁死亡,拓宽了局域性空间信号通路对氧化应激特别是脂质过氧化的防御机制的理解,并为基于铁死亡疗法高效杀伤结直肠癌细胞提供了一个新的分子靶点。
该研究获得了国家自然科学基金委的经费支持。44118太阳成城集团胡颖教授为该文的通讯作者。博士生刘皓和助理教授郑善亮为该文的共同第一作者。华大基因侯桂雪博士、胡颖团队其他成员参与其中。该研究获得了44118太阳成城集团杨帆副研究员、科研助理赵雅楠以及哈尔滨医科大学附属肿瘤医院李栗医生的大力支持。
原文链接:https://www.nature.com/articles/s41418-024-01414-2#Abs1

